Uso off-label de medicamentos e suas implicações da prescrição ao marketing
Os desafios do uso de medicamentos fora da sua indicação na bula.

A prática da prescrição off-label de medicamentos é um tema complexo e multifacetado, que envolve questões clínicas, éticas, regulatórias e de segurança. Essa prática, embora comum, traz consigo uma série de desafios e responsabilidades para os profissionais de saúde, pacientes e agências reguladoras.¹

A American Medical Association (AMA) reconhece a prescrição off-label como um direito do médico. Contudo, essa abordagem exige uma análise rigorosa por parte dos profissionais de saúde, considerando riscos, efeitos colaterais e a melhor abordagem para o paciente, já que a ausência de uma aprovação formal implica em uma maior incerteza sobre a relação risco-benefício do tratamento.²
Nesse contexto, as ações de farmacovigilância desempenham um papel fundamental. O relato de experiências clínicas – sejam elas bem-sucedidas ou adversas – contribui para a construção de um banco de dados robusto, permitindo uma melhor compreensão da eficácia e segurança dessas prescrições.²
O off-label como recurso terapêutico
Algumas das principais razões para a prescrição off-label incluem:
- Necessidades médicas não atendidas em determinadas áreas terapêuticas;²
- Ausência de estudos em grupos especiais da população – como crianças, gestantes, lactantes e idosos;²
- Falta de formulações farmacêuticas adequadas;²
- Falta de alternativas terapêuticas para determinados pacientes, seja por suas características fisiológicas e/ou patológicas individuais, ou pela falha do tratamento convencional.²
É preciso ressaltar que em muitas situações clínicas, o uso off-label representa a única alternativa viável para o tratamento de determinados pacientes, diante das razões citadas acima. Este cenário tem sido reconhecido inclusive pelo sistema judiciário brasileiro.³
Em 2023, o Superior Tribunal de Justiça (STJ) decidiu que os convênios de saúde devem cobrir medicamentos registrados na Agência Nacional de Vigilância Sanitária (Anvisa), mesmo que prescritos off-label, reforçando que a prescrição médica deve ser respeitada.³
A decisão foi reforçada pela Lei 14.454/2022, que define o rol da Agência Nacional de Saúde Suplementar (ANS) como referência básica, mas não limitadora, para cobertura de tratamentos.⁴
Vale lembrar que o que hoje é considerado off-label pode ser aprovado futuramente, conforme novas evidências se consolidem. Quando baseado em fortes evidências científicas e no julgamento médico, pode representar a melhor alternativa para garantir o cuidado adequado e individualizado ao paciente.¹

A qualidade das evidências para a prescrição off-label costuma ser frágil, já que esses medicamentos não passam pelo mesmo nível de testagem e avaliação exigidos para aprovação regulatória.²⁻⁵
Além disso, essa prática pode isentar a indústria da necessidade de desenvolver novos ensaios clínicos para validar novas indicações. Isso implica na ausência de diretrizes sobre faixas de doses seguras e contraindicações adequadas.⁵
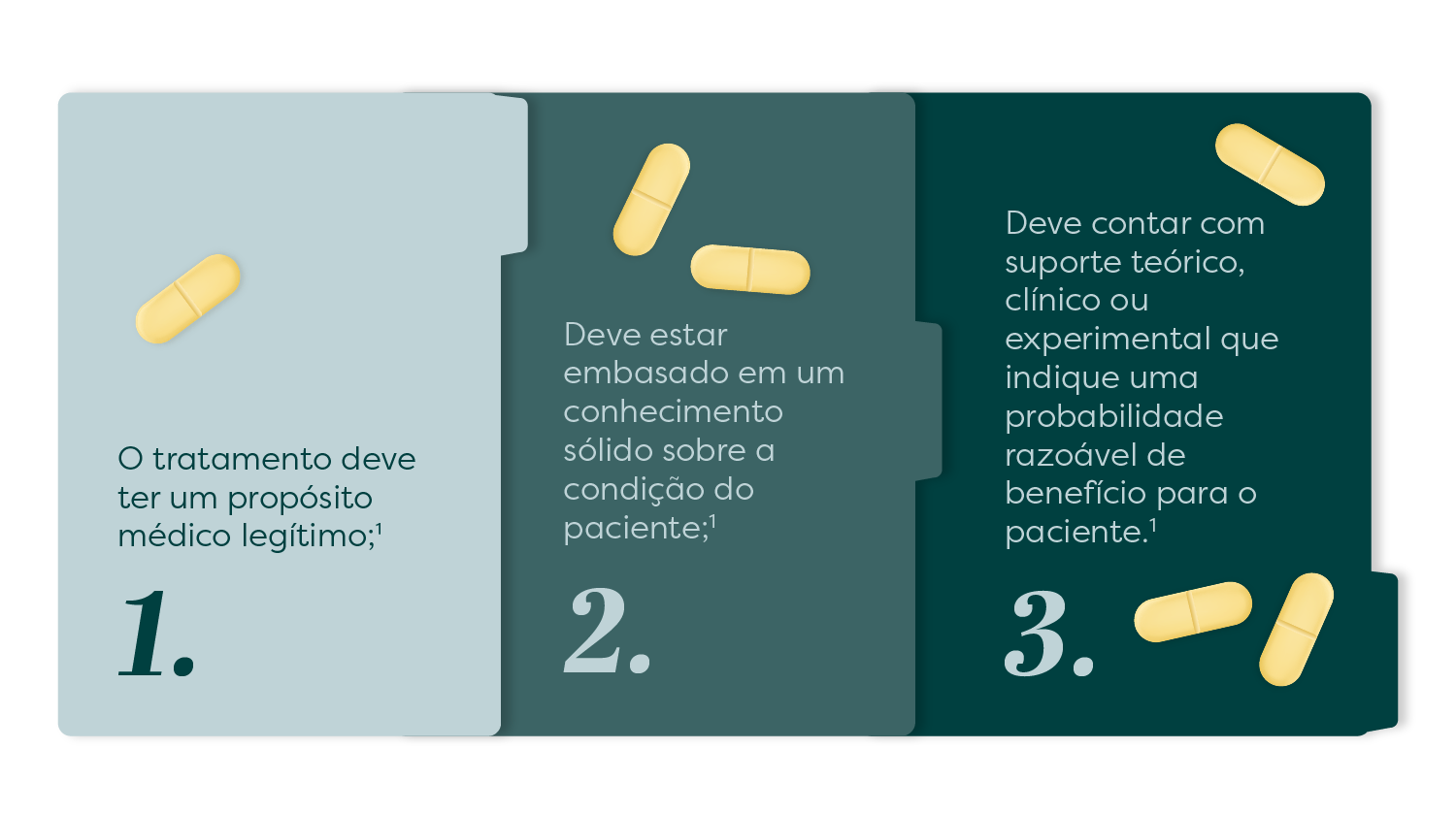
O uso off-label deve ser considerado de forma ética, baseado em evidências científicas sólidas e em uma fundamentação médica robusta. Esse posicionamento se apoia em princípios essenciais da prática médica:¹
O desafio? Grande parte dessas prescrições ocorre sem o respaldo científico adequado.¹
Um estudo em pacientes adultos demonstrou que o uso off-label sem respaldo em evidências científicas robustas, esteve associado a um aumento superior a 50% na ocorrência de eventos adversos, quando comparado ao uso on-label. Em contrapartida, quando há fortes evidências científicas, o risco de eventos adversos tende a se equiparar ao observado nas indicações aprovadas.⁶
Problemas e surpresas do off-label na prática
Nos Estados Unidos na década de 1970, dois medicamentos foram aprovados individualmente pela Food and Drug Administration (FDA) como tratamento de curto prazo para auxiliar na perda de peso.¹
No entanto, após a publicação de um artigo relatando uma perda de peso significativa quando usados em combinação off-label, diversos médicos passaram a prescrevê-los juntos.⁷
Pouco tempo depois, descobriu-se que quase 1/3 dos pacientes que utilizaram essa combinação sofreram danos graves nos pulmões e no coração. Aproximadamente 21% precisaram de cirurgia cardíaca, e muitos desenvolveram invalidez ou faleceram.¹
Como consequência, mais de 20.000 processos foram movidos contra a farmacêutica responsável, e ambos os medicamentos foram retirados do mercado em 1997.¹
E esse não foi um caso isolado. Outros exemplos de uso off-label com consequências graves incluem:¹
- Um medicamento aprovado para prevenir convulsões parciais que, quando utilizado off-label para tratar dor, provocou novas convulsões;¹
- Um medicamento contra a malária prescrito off-label para cãibras, que levou a sangramentos com risco de vida.¹
Vamos mergulhar agora em três casos recentes e populares:
Caso COVID
Mais recentemente, a pandemia de COVID-19 evidenciou os riscos do uso indiscriminado de medicamentos reposicionados, com o uso off-label da cloroquina e outros fármacos do chamado “Kit COVID”, amplamente disseminado no Brasil.⁵⁻⁸
Além da ineficácia comprovada contra a COVID-19, o uso desses medicamentos gerou uma falsa sensação de segurança. Muitas pessoas acreditavam estar protegidas contra a infecção pelo coronavírus e, consequentemente, relaxaram nas medidas preventivas eficazes, como o uso de máscaras e o distanciamento social. O resultado foi um aumento de 50% na taxa de infecção entre indivíduos que utilizaram o “Kit COVID” como medida profilática.⁸
Estima-se, também, que quase 1 em cada 4 brasileiros tenham utilizado esses fármacos, o que pode ter contribuído para sua escassez entre pacientes que realmente necessitavam deles para indicações aprovadas.⁸
Caso rituximabe
Outro exemplo relevante do uso off-label é o do rituximabe, um anticorpo monoclonal aprovado para o tratamento de certos tipos de câncer e algumas doenças autoimunes.⁹
Porém, o custo elevado do rituximabe e sua indicação fora da bula em muitas dessas condições têm motivado a recusa de cobertura por parte de operadoras de planos de saúde.¹⁰
Em 2023, um caso envolveu uma paciente hospitalizada com complicações decorrentes de uma doença autoimune, para a qual o rituximabe havia sido prescrito. A operadora recusou o custeio do tratamento sob a justificativa de que o medicamento não constava no rol da ANS e nem possuía indicação expressa em bula para aquela condição específica.³
A controvérsia chegou ao Superior Tribunal de Justiça (STJ), que, por unanimidade, considerou a negativa abusiva. A Quarta Turma da Corte entendeu que, desde que o medicamento tenha registro na Anvisa, sua prescrição por um profissional habilitado deve prevalecer, ainda que off-label ou em caráter experimental.³
O relator do caso, ministro Raul Araújo, destacou que a jurisprudência do STJ admite a cobertura nesses casos, especialmente quando não há substituto terapêutico disponível e certos critérios técnicos são preenchidos.³
Esse entendimento reafirma que a escolha do tratamento é prerrogativa do médico e não pode ser arbitrariamente desconsiderada pela operadora de saúde. A definição do que constitui um tratamento experimental ou de eficácia reconhecida cabe ao Conselho Federal de Medicina (CFM), que regulamenta a prática médica por meio de pareceres técnicos e éticos. Cabe às operadoras respeitar essas diretrizes, garantindo ao paciente o acesso a terapias indicadas por seu médico assistente.¹⁰
Outro exemplo relevante do uso off-label é o do rituximabe, um anticorpo monoclonal aprovado para o tratamento de certos tipos de câncer e algumas doenças autoimunes.⁹
Porém, o custo elevado do rituximabe e sua indicação fora da bula em muitas dessas condições têm motivado a recusa de cobertura por parte de operadoras de planos de saúde.¹⁰
Em 2023, um caso envolveu uma paciente hospitalizada com complicações decorrentes de uma doença autoimune, para a qual o rituximabe havia sido prescrito. A operadora recusou o custeio do tratamento sob a justificativa de que o medicamento não constava no rol da ANS e nem possuía indicação expressa em bula para aquela condição específica.³
A controvérsia chegou ao Superior Tribunal de Justiça (STJ), que, por unanimidade, considerou a negativa abusiva. A Quarta Turma da Corte entendeu que, desde que o medicamento tenha registro na Anvisa, sua prescrição por um profissional habilitado deve prevalecer, ainda que off-label ou em caráter experimental.³
O relator do caso, ministro Raul Araújo, destacou que a jurisprudência do STJ admite a cobertura nesses casos, especialmente quando não há substituto terapêutico disponível e certos critérios técnicos são preenchidos.³
Esse entendimento reafirma que a escolha do tratamento é prerrogativa do médico e não pode ser arbitrariamente desconsiderada pela operadora de saúde. A definição do que constitui um tratamento experimental ou de eficácia reconhecida cabe ao Conselho Federal de Medicina (CFM), que regulamenta a prática médica por meio de pareceres técnicos e éticos. Cabe às operadoras respeitar essas diretrizes, garantindo ao paciente o acesso a terapias indicadas por seu médico assistente.¹⁰
Caso semaglutida
Outro exemplo emblemático e atual do uso off-label é a trajetória da semaglutida. Inicialmente aprovada para o tratamento do diabetes tipo 2, a medicação ganhou notoriedade por seu efeito significativo na redução de peso corporal — o que levou, ainda antes da sua aprovação formal para essa nova indicação, ao uso off-label por pacientes com obesidade.¹¹
Em 2023, a semaglutida foi aprovada pela Anvisa para o tratamento da obesidade. Estudos clínicos robustos, demonstraram reduções de peso em torno de 17% quando a medicação foi associada a intervenções no estilo de vida.¹¹
No entanto, a crescente popularização da semaglutida nas redes sociais e na mídia, muitas vezes desvinculada da sua real indicação médica, acende um sinal de alerta. O uso indiscriminado, especialmente com fins puramente estéticos e sem acompanhamento profissional, não só eleva o risco de eventos adversos (como náuseas, vômitos, constipação, disfunções renais e pancreatite), como também contribui para o estigma que ainda recai sobre o tratamento da obesidade, que é uma patologia multifatorial e complexa.¹²
O aumento dessa demanda é impulsionado, em parte, pela disseminação de informações nas redes sociais, onde relatos pessoais e promessas de transformação corporal acabam ofuscando as diretrizes médicas baseadas em evidências científicas.¹²

Essa tendência não apenas desvia o foco da abordagem integral necessária para tratar a obesidade, mas também pode colocar em risco a saúde dos indivíduos ao negligenciar a importância de hábitos saudáveis e acompanhamento profissional adequado.¹²
A Sociedade Brasileira de Endocrinologia e Metabologia (SBEM) e a Associação Brasileira para o Estudo da Obesidade e Síndrome Metabólica (ABESO) reforçam que a semaglutida, assim como outros medicamentos aprovados pela Anvisa, são ferramentas terapêuticas importantes para suas indicações, desde que sejam utilizadas a partir da prescrição médica e do acompanhamento profissional adequado.¹³
Marketing off-label: uma fronteira ética e legal
Diferente da prescrição médica off-label, que se baseia no julgamento clínico e nas necessidades individuais dos pacientes, o marketing off-label refere-se à promoção de um medicamento para indicações não aprovadas pelos órgãos reguladores.¹⁴

As empresas farmacêuticas podem submeter novos estudos ao órgão regulador para obter aprovação de marketing para novas indicações, grupos de pacientes expandidos e recomendações sobre dosagem e administração.¹⁴
No Brasil, a Anvisa regula a propaganda de medicamentos por meio da RDC 96/08, partindo do princípio de que os medicamentos não são bens de consumo comuns, mas sim bens de saúde.¹⁵⁻¹⁶
Por isso, sua publicidade está sujeita a regras específicas.¹⁶
A legislação é clara: nenhum produto pode ser fabricado, exposto à venda ou entregue ao consumo sem registro no Ministério da Saúde, conforme estabelecido no artigo 12 da Lei nº 6.360/76.¹⁵⁻¹⁷
A propaganda de produtos sem registro expõe a população a riscos sanitários elevados, uma vez que sua qualidade, eficácia e segurança não foram avaliadas pela vigilância sanitária, tornando a sua atuação no organismo imprevisível.¹⁵
Isso pode resultar em contaminações, reações alérgicas, ineficácia ou efeitos adversos inesperados, incluindo óbitos, dependendo das condições do produto e das características individuais dos pacientes.¹⁵
Os danos ao paciente decorrentes da promoção off-label incluem:
- Contaminações;¹⁵
- Reações alérgicas;¹⁵
- Prescrição de tratamentos mais caros e menos eficazes;¹⁴
- Exposição a efeitos adversos de medicamentos inadequadamente testados;¹⁴
- Óbito.¹⁵
Além disso, o marketing off-label desestimula a inovação, pois permite que fabricantes expandam o mercado de um produto sem a necessidade de investir em novos medicamentos ou dispositivos com eficácia comprovada. Isso reduz os incentivos para a realização de estudos robustos que comprovem a segurança e eficácia de um medicamento para novas indicações.¹⁴
Por isso, a propaganda de um medicamento deve estar estritamente alinhada às informações registradas na Anvisa. Dessa forma, qualquer dado sobre ação do medicamento, indicações, posologia, modo de uso, reações adversas, eficácia, segurança e qualidade deve ser compatível com o que consta no registro oficial.¹⁵
Isso significa que mesmo que estudos científicos apontem novas indicações ou benefícios adicionais, essas informações não podem ser utilizadas em materiais promocionais sem a devida aprovação regulatória.¹⁵
Além disso, clínicos e pesquisadores acadêmicos têm um papel essencial na promoção de normas éticas relacionadas à propaganda de medicamentos como:¹⁴
- Educar pesquisadores e clínicos sobre práticas de marketing relacionadas ao uso off-label;¹⁴
- Estabelecer diretrizes para a pesquisa ética e as relações entre autores e patrocinadores de estudos;¹⁴
- Proibir contratos que permitam aos patrocinadores redigir, editar ou suprimir dados científicos, ou influenciar sua publicação;¹⁴
- Definir penalidades severas para violações dessas normas;¹⁴
- Criar mecanismos para relatar suspeitas de má conduta acadêmica tanto à instituição quanto aos periódicos envolvidos.¹⁴
Por outro lado, médicos e outros profissionais da saúde possuem maior liberdade regulatória para discutir usos off-label, desde que não haja conflito de interesses ou vieses. Eles podem abordar o tema com pacientes individuais e em ambientes voltados para conhecimento e discussão entre HCPs, mas não para o público em geral.¹⁴
Considerações Finais
A prática off-label representa tanto uma oportunidade quanto um desafio para a medicina moderna. Embora possa oferecer benefícios terapêuticos valiosos, especialmente em áreas carentes de tratamentos eficazes, seu uso deve ser embasado em evidências científicas e conduzido com responsabilidade.¹⁻²
Atualmente, não existem diretrizes claras para determinar quais usos off-label são suficientemente embasados por evidências médicas e quais não são. Porém, existem características que devem servir como alerta para uma avaliação mais criteriosa antes da prescrição, como:¹
- Uso off-label de um medicamento recém-aprovado, que ainda não teve seu perfil de segurança amplamente estabelecido;¹
- Aplicação em indicações completamente novas, sem respaldo de estudos clínicos prévios;¹
- Prescrição off-label em populações vulneráveis, historicamente sub-representadas em ensaios clínicos;¹
- Uso baseado apenas em experiência anedótica, sem suporte de evidências robustas.¹
O marketing off-label, por outro lado, apresenta riscos significativos e a sua prática é proibida, para evitar danos aos pacientes e à credibilidade da ciência médica.¹⁴⁻¹⁵
O papel dos profissionais de saúde na prescrição off-label é essencial, e cabe às agências reguladoras garantir que essa prática seja realizada de maneira ética e segura. O avanço das pesquisas clínicas e a transparência na comunicação de riscos são fundamentais para equilibrar a inovação terapêutica com a segurança do paciente.²⁻¹⁴⁻¹⁵
Referências Bibliográficas
-
- VAN NORMAN, G. A. Off-Label Use vs Off-Label Marketing of Drugs. Part 1. JACC: Basic to Translational Science, v. 8, n. 2, p. 224–233, fev. 2023.
- RUSZ, C.-M. et al. Off-Label Medication: From a Simple Concept to Complex Practical Aspects. International Journal of Environmental Research and Public Health, v. 18, n. 19, p. 10447, 1 jan. 2021.
- SUPERIOR TRIBUNAL DE JUSTIÇA. Plano não pode negar custeio de remédio registrado na Anvisa, mesmo que prescrição seja off-label. Superior Tribunal de Justiça. Disponível em: <https://www.stj.jus.br/sites/portalp/Paginas/Comunicacao/Noticias/2023/12092023-Plano-nao-pode-negar-custeio-de-remedio-registrado-na-Anvisa–mesmo-que-prescricao-seja-off-label.aspx>. Acesso em: 22 abr. 2025.
- BRASIL. Lei No 14.454, de 21 de setembro de 2022. Disponível em: <https://www.planalto.gov.br/ccivil_03/_ato2019-2022/2022/lei/l14454.htm>. Acesso em: 22 abr. 2025.
- CAETANO, R. et al. Autorização para uso off-label pode não ser benéfica para o Sistema Único de Saúde. Cadernos de Saúde Pública, v. 39, n. 6, p. e00085423, 26 jun. 2023.
- EGUALE, T. et al. Association of Off-label Drug Use and Adverse Drug Events in an Adult Population. JAMA internal medicine, v. 176, n. 1, p. 55–63, 2016.
- CONNOLLY, H. M. et al. Valvular heart disease associated with fenfluramine-phentermine. The New England Journal of Medicine, v. 337, n. 9, p. 581–588, 28 ago. 1997.
- SANTOS, M.; NEGRI BOSCHIERO, M.; AUGUSTO, F. Efficacy of Ivermectin, Chloroquine/Hydroxychloroquine, and Azithromycin in Managing COVID-19: A Systematic Review of Phase III Clinical Trials. Biomedicines, v. 12, n. 10, p. 2206–2206, 27 set. 2024.
- AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Bulário Eletrônico. Agência Nacional de Vigilância Sanitária. Disponível em: <https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=Mabthera>. Acesso em: 23 abr. 2025.
- MARANHÃO, David Vinicius do Nascimento . A negativa, pelo plano de saúde, de cobertura do medicamento Rituximabe utilizado como off-label é abusiva. Jusbrasil. Disponível em: <https://www.jusbrasil.com.br/artigos/a-negativa-pelo-plano-de-saude-de-cobertura-do-medicamento-rituximabe-utilizado-como-off-label-e-abusiva/2030229433>. Acesso em: 23 abr. 2025.
- TRIBUNAL DE JUSTIÇA DO DISTRITO FEDERAL E DOS TERRITÓRIOS. Semaglutida: como funciona o tratamento contra a obesidade. Tribunal de Justiça do Distrito Federal e dos Territórios. Disponível em: <https://www.tjdft.jus.br/informacoes/programas-projetos-e-acoes/pro-vida/dicas-de-saude/pilulas-de-saude/semaglutida-como-funciona-o-tratamento-contra-a-obesidade>. Acesso em: 8 abr. 2025.
- BEZERRA, Thaynara Paula Warren; SOUZA, Pedro César de; GOMES, Paulo André Teixeira de Morais; et al. Perigos e consequências do uso indiscriminado de Ozempic no emagrecimento. REVISTA FOCO, v. 17, n. 6, p. e5289–e5289, 2024.
- SOCIEDADE BRASILEIRA DE ENDOCRINOLOGIA E METABOLOGIA. Esclarecimentos da SBEM e ABESO sobre a semaglutida. Sociedade Brasileira de Endocrinologia e Metabologia. Disponível em: <https://www.endocrino.org.br/noticias/esclarecimentos-da-sbem-e-abeso-em-relacao-ao-uso-da-semaglutida/>. Acesso em: 8 abr. 2025.
- VAN NORMAN, G. A. Off-Label Use vs Off-Label Marketing. Part 2. JACC: Basic to Translational Science, v. 8, n. 3, p. 359–370, 1 mar. 2023.
- AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Regulamentação da propaganda de medicamentos | RD6 96 Perguntas e Respostas. Agência Nacional de Vigilância Sanitária. Disponível em: <https://www.gov.br/anvisa/pt-br/assuntos/fiscalizacao-e-monitoramento/propaganda/legislacao/arquivos/8815json-file-1>. Acesso em: 11 mar. 2025.
- AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Regras básicas de propaganda. Disponível em: <https://www.gov.br/anvisa/pt-br/assuntos/fiscalizacao-e-monitoramento/propaganda/propaganda>. Acesso em: 11 mar. 2025.
- BRASIL. Lei Nº 6.360, de 23 de setembro de 1976. Disponível em: <https://www.planalto.gov.br/ccivil_03/leis/l6360.htm>. Acesso em: 12 mar. 2025.